Laborbereich
Virotherapie - Eine innovative Therapie gegen Krebs
Im Mittelpunkt unseres Interesses steht die Entwicklung onkolyticher Viren zur Tumortherapie, die auch als Virotherapie bezeichnet wird. Diese Viren zeichnen sich dadurch aus, dass sie sich nur in Tumorzellen vermehren und diese letztlich zerstören. Die neu hergestellten Viruspartikel werden nach Zellyse freigesetzt und infizieren neue Tumorzellen. So wird die Tumorzelle selbst zu einer Produktionsstätte von „Tumor-Medikamenten“ (Abbildung 1).
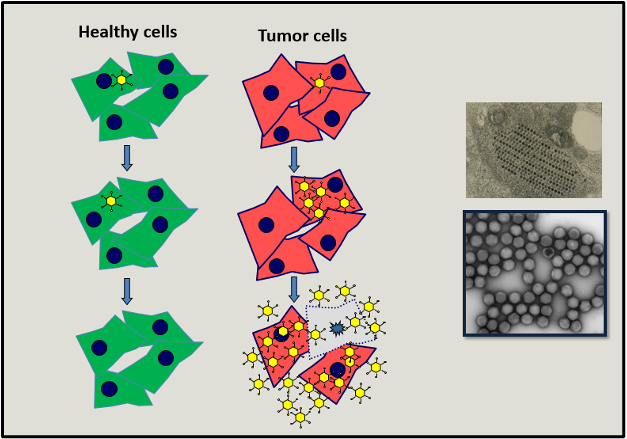
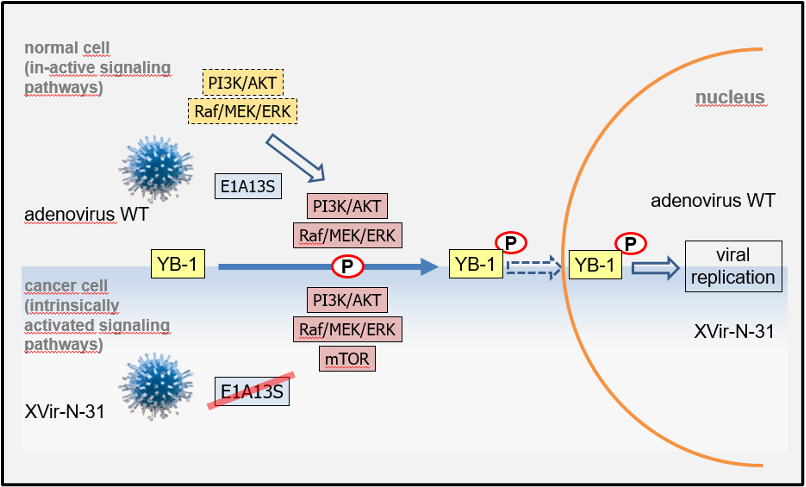
In den letzten Jahren hat sich die Virotherapie dank des Verständnisses der Virus- und Tumorbiologie und der daraus folgenden Entwicklung von onkolytischen Viren mit einem hohen Sicherheits- und Aktivitätsprofil von einem experimentellen Ansatz zu einer Therapieoption weiterentwickelt. Dies wird auch mit großen Teilerfolgen in klinischen Studien belegt. Im Jahr 2015 wurde ein erstes onkolytisches Virus in den USA und Europa zur Behandlung des fortgeschrittenen malignen Melanoms zugelassen.Die adenovirale Replikation wird sowohl durch Proteine der infizierten Zelle als auch durch viral synthetisierte Proteine reguliert. Wir konnten nachweisen, dass neben dem viralen Protein E1A das zelluläre Protein Y-Box-bindende Protein 1 (YB-1) eine Schlüsselstellung bei diesem Prozess einnimmt (Holm, et al. 2002; Holm et al 2004; Mantwill et al 2013). Mit dem Wissen hat unsere Gruppe aus einem Adenovirus, welches normalerweise Erkältungen verursacht, ein onkolytisches Virus (XVir-N-31) für die Behandlung von Tumoren entwickelt. Bisherige Daten zeigen, dass dieses Virus mit einer hohen Effizienz Tumorzellen infiziert und diese lysiert. Somit kann es auch für die Therapie von Plattenepithelkarzinomen im Kopf- und Halsbereich (HNSCC: Head and neck squamous cell carcinoma) genutzt werden. Grundvoraussetzung für die Anwendung des Virus ist das Sicherheitsprofil, also die Beschränkung der viralen Replikation, Vermehrung und die damit verbundene Zellzerstörung auf Tumorzellen. Unser Virus X-Vir-N-31 verfügt deshalb über spezifische Genommodifikationen, durch die es nur in Tumorzellen, in denen das Onkoprotein YB-1 im Kern vorliegt, replizieren kann und diese dadurch zerstört. Die Abhängigkeit des Lebenszyklus unseres Virus von YB-1 stellt den wesentlichen Unterschied zu anderen onkolytischen Viren dar (Abbildung 2)
Das Forschungsprogramm der MKG Virotherapie
Der Schwerpunkt unserer Forschung liegt auf der Effizienzsteigerung der YB-1 basierten Virotherapie. Zum einen entwickeln wir auf dieser Grundlage weitere onkolytische Viren durch molekulare Modifikation des Virusgenoms („arming“), zum anderen untersuchen wir Kombinationstherapien. Besonders attraktiv erscheinen aktuell, die vielen Möglichkeiten die Virotherapie mit etablierten medikamentösen Therapien zu kombinieren. Die MKG Virotherapie hat zum Ziel, die wirksamsten onkolytischen Therapien in die klinische Anwendung zu bringen.
Forschungsschwerpunkte
- Modifikationen im Virusgenom zur Steigerung der onkolytischen Aktivität
- Identifizierung neuartiger Kombinationstherapien
- Untersuchungen zum immunogenen Zelltod
- Einfluss epigenietischer Prozesse auf die Virusreplikation
Spezifische Forschungsprojekte im Überblick
Zellzyklus-Regulation
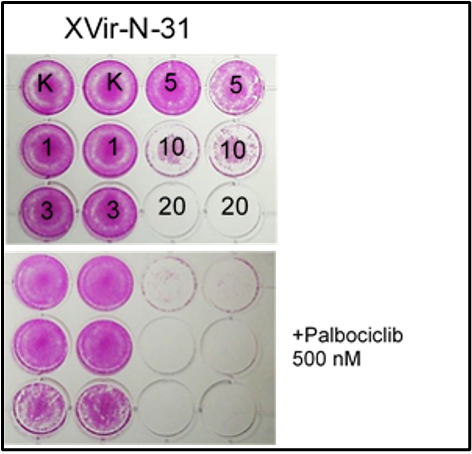
Das Retinoblastom-Protein (RB) ist ein Tumorsuppressor-Protein, welches eine Schlüsselrolle bei der Zellzyklusregulation einnimmt. Im aktiven Zustand bindet es an den humanen Transkriptionsfaktor E2F und verhindert dadurch den Übergang der Zellen in die S-Phase (G1-Arrest). Durch Phosphorylierung verliert RB seine Repressorfunktion und erlaubt die Freisetzung von E2F, welches dann wiederum das Zellwachstum fördert. Diese Phosphorylierung wird von Cyclin-abhängigen Kinase (CDK) 4/6 und Cyclin E/CDK2 durchgeführt. Erste vielversprechende Ergebnisse zeigen, dass Palbociclib (Handelsname Ibrance©), ein zur Behandlung von lokal fortgeschrittenem oder metastasiertem Brustkrebs eingesetzter CDK4/6-Inhibitor, in Kombination mit YB-1 basierter Virotherapie die Zelllyse in Hals-Kopf-Tumoren signifikant steigert.
Immuntherapien
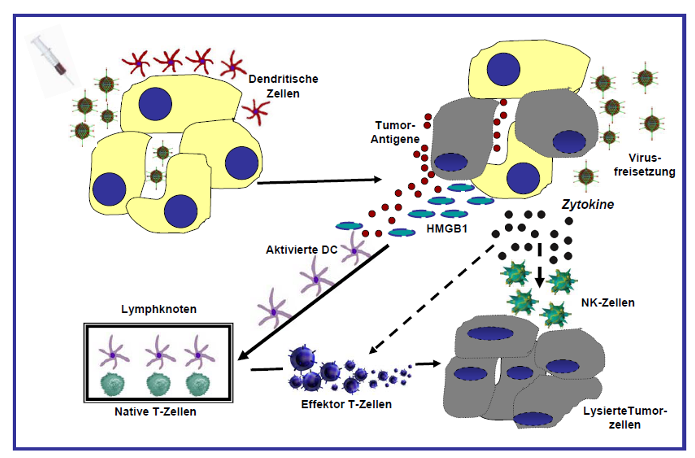
Klinische Fallberichte über komplette Tumor-Remissionen nach Virusinfektion haben durch den enormen Erkenntnisgewinn im Bereich der Immunologie in den letzten Jahren eine erhöhte Aufmerksamkeit gefunden. Präklinische sowie klinische Studien belegen zweifelsfrei, dass Virotherapien neben der Tumorzelllyse eine Immunreaktion gegen den Tumor auslösen. Dabei spielt der sogenannte immunogene Zelltod eine zentrale Rolle. Dieser ist dadurch gekennzeichnet, dass vermehrt Tumorantigene sowie Gefahrenstoffe (engl. DAMPS: Damage-associated molecular patterns) wie Beispielsweise HMGB1 und Zytokine/Chemokine freigesetzt werden, wodurch eine effektive Immunreaktion hervorrufen wird. Es ist zu erwarten, dass es in näherer Zukunft möglich sein wird, durch gezieltes Induzieren eines immunogenen Zelltodes den Erfolg der Virotherapie zu verstärken bzw. ihr Anwendungsspektrum zu erweitern. Deshalb liegt unser Interesse in der Erforschung der molekularen Mechanismen der virusinduzierten Tumorlyse sowie der Beeinflussung dieser. Zusätzlich untersuchen wir, ob immunmodulierende Proteine wie Zytokine, Immun-Checkpoint-Inhibitoren oder bispezifische Antikörper als Transgene („arming“) die Immunantwort positiv beeinflussen („onkolytische Immuntherapie“).
Epigenetische Interventionen
Bromodomänen und extra-terminale Protein (BET)-Inhibitoren gehören einer neuen Klasse von Krebstherapeutika an, den sogenannten epigenetischen Medikamenten. Diese Medikamente binden an Bromodomänen von Proteinen (Proteininteraktionsdomänen), welche spezifisch acetylierte Lysinreste vor allem auf Histonproteinen erkennen und diese bindeen. Bekannte Vertreter der BET-Familie sind die Proteine BRD2 und BRD4. Da sie an Transkriptionsfaktoren binden, spielen diese Proteine eine wichtige Rolle in der Regulation der Genexpression. BET-Inhibitoren zeigen eine hohe Selektivität gegenüber Tumorzellen auf und werden daher als potentielle Wirkstoffkandidaten in der Krebstherapie untersucht. Es ist seit langem bekannt, dass Adenoviren das Acetylierungs-Profil von infizierten Zellen beeinflussen, um eine effektive Replikation der Virus-DNA sicherzustellen. Ob BET-Inhibitoren in Kombination mit der YB-1 basierten Virotherapie zur Tumortherapie gegen HNSCC eingesetzt werden können, wird gegenwärtig im Rahmen eines weiteren Projekts untersucht.
Klinische Studien
Unsere Klinik führt regelmäßig prospektive und retrospektive klinische Studien durch. Das Ziel einer aktuell laufenden prospektiven Studie besteht darin, die therapeutische Einflussnahme von PRF bzw. seiner regenerativen Inhaltskomponenten, welche im Rahmen der Kiefergelenksarthroskopie in den oberen Gelenksspalt eingebracht werden, auf das kurz-, mittel- und langfristig zu bewertende funktionelle, klinische und radiologische Behandlungsergebnis zu untersuchen.
Weitere klinische Studien dienen der Qualitätskontrolle verschiedener chirurgischer Maßnahmen in der Traumatologie und Dysgnathiechirurgie. Neben traumatologischen Studien prüfen und Erweitern wir die Möglichkeiten der Inhouse-Planung zur vollständigen Implantat-prothetischen Neuversorgung von Tumorpatienten nach komplexen Resektionen unter Einbeziehung von Ober- oder Unterkiefer und anschließender Rekonstruktion.Weitere Projekte beschäftigen sich mit der mathematischen Modellierung und Simulation von Gesichtsschädelasymmetrien, für die Operationsplanung kommen unterschiedliche 3D-Verfahren (Rapid Manufacturing, 3D-Visualisierung) zum Einsatz. In der Planung und Nachsorge der Fehlbildungschirurgie werden 3D-Weichgewebe-Visualisierungsmethoden mithilfe verschiedener Oberflächen-Scanverfahren (Laser, holographische 3D-Bildgebung, Weißlicht) genutzt und weiterentwickelt. Die Einsatzmöglichkeiten der intraoperativen Navigation werden kontinuierlich mithilfe der Augmented-, Mixed- und Virtual Reality erweitert.




