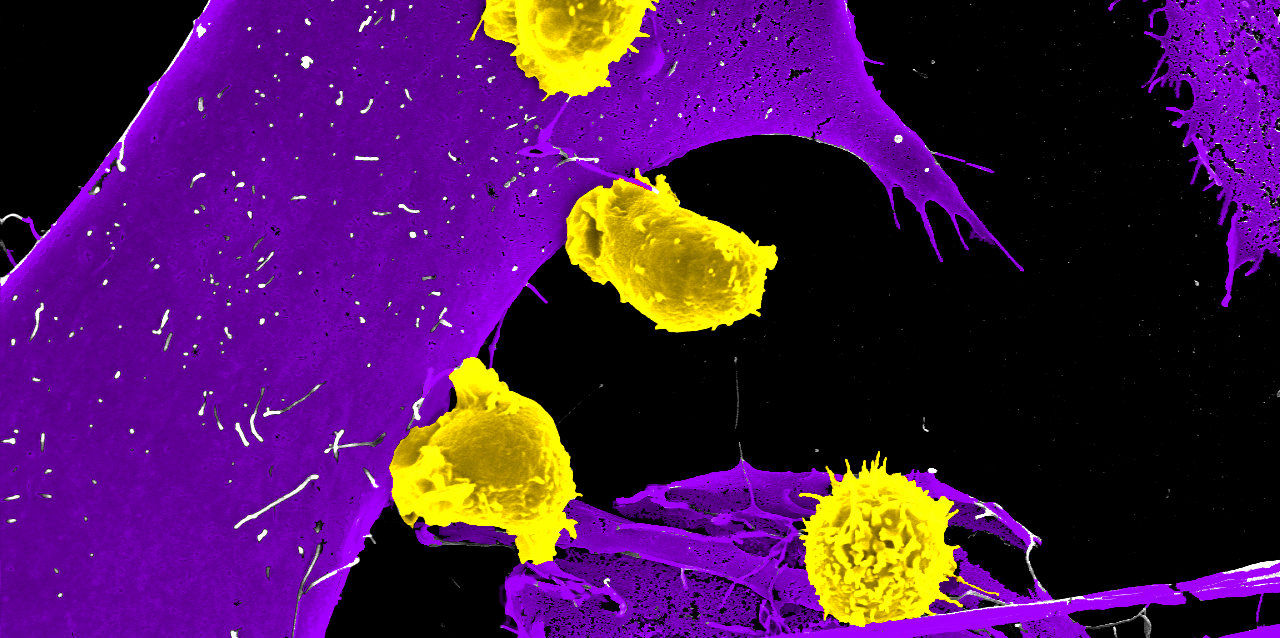
Neuartige CAR-T-Zelltherapie als vielversprechende Option bei aggressiven Lungentumoren
Von neuen immuntherapeutischen Medikamenten wie der CAR-T-Zelltherapie profitieren vor allem PatientInnen mit Blutkrebs. Bei soliden, also festen Tumoren ist der durchschlagende Erfolg bislang ausgeblieben. Das soll sich mit der Zusammenarbeit des Teams um Zellgenetiker Gottfried Baier von der Medizin Uni Innsbruck und dem Wiener Biotech-Unternehmen invIOs bald ändern: Sie setzen auf die Blockade von Checkpoint Proteinen in CAR-T-Zellen. Die FFG unterstützt das Vorhaben.
Vor zehn Jahren wurden die ersten Leukämiepatientinnen mit chimären Antigenrezeptor (CAR) exprimierenden T-Zellen behandelt. Ein Jahrzehnt später sind viele der Betroffenen noch immer ohne Krankheitssymptome. Im Rahmen dieser innovativen CAR-T-Zell-Therapie werden bestimmte Immunzellen, die T-Zellen, aus dem Blut der PatientInnen gewonnen und in der Folge gentechnisch aufgerüstet und den PatientInnen über eine Infusion wieder zugeführt. Die mit einem Tumorerkennungsrezeptor ausgestatteten CAR-T-Zellen sind in der Lage, Tumorzellen gezielt zu erkennen, an diese anzudocken und sie zu zerstören. Bei schwer behandelbaren soliden Krebserkrankungen wie dem nicht-kleinzelligen Lungenkarzinom (NSCLC) blieb jegliche Wirksamkeit von CAR-T-Zellen bislang jedoch aus.
Im Fokus: Immun-Checkpoint Molekül CBLB
Gottfried Baier, Direktor des Instituts für Zellgenetik an der Medizin Uni Innsbruck und österreichischer Pionier der Krebsimmuntherapie, ist den Ursachen der Therapieresistenz von CAR-T bei NSCLC auf der Spur. Mit seinem Team konnte er bereits mehrfach belegen, dass das intrazelluläre Protein CBLB eine Schlüsselrolle in der Hemmung der anti-tumoralen Funktion von Immunzellen einnimmt: „Krebszellen wenden verschiedene Tricks an, um dem Immunsystem zu entkommen und das Protein CBLB fungiert dabei als eine Art Checkpoint in der Anti-Tumor-Immunantwort. Der Tumor missbraucht sozusagen die Immunzelle und macht aus einer tumorbekämpfenden Zelle eine inaktive und für den Tumor völlig harmlose Zelle“.
Neueste Erkenntnisse von zugrundeliegenden Mechanismen, die in enger Zusammenarbeit mit PostDoc Sebastian Peer und dem Immun-Onkologen Dominik Wolf (Direktor der Innsbrucker Univ.-Klinik für Onkologie und Hämatologie), im Rahmen der zwei laufenden ERC-Projekte „HOPE“ und „CAR-T(uning)“ von Gottfried Baier erarbeitet wurden, zeigen, dass Immun-Checkpoints in der Krebsimmuntherapie mit CAR-T-Zelltherapien bei bestimmten Tumoren eine wichtige Rolle spielen.
Mit der Blockade von Immun-Checkpoint Molekülen in CAR-T-Zellen könnte sich nun eine vielversprechende Therapieoption eröffnen, die tumorzellschädigende Funktion der schon heute verfügbaren CAR-T Zellen am Ort des soliden Tumors entscheidend zu verbessern. Solcherart hergestellte Zellen könnten ein potenziell effektives „lebendes Medikament“ zur Abtötung von Tumorzellen auch in der immunsuppressiven Tumorumgebung darstellen. Genau diesen Weg wollen Gottfried Baier und invIOs in einem neuen, von der FFG geförderten BRIDGE*-Projekt (Extension of CD8 CAR-T cell therapy success by CBLB pathway blockade; Acronym „EXCEL-T“) beschreiten.
„Wir wollen die Wirksamkeit von CAR-T Immunzelltherapie speziell bei soliden Tumoren wie NSCLC wesentlich und bestmöglich verstärken, und gleichzeitig mittels des patienteneigenen Immunsystems die Anti-Tumorimmunität ankurbeln und bisher beobachtete Therapieresistenzen langfristig vermeiden“, beschreibt Gottfried Baier das gemeinsame Projektziel.
Alexander Dohnal, Leiter der Forschungs- und Entwicklungsabteilung von invIOs, ergänzt: „Erste Ergebnisse unserer klinischen Untersuchungen weisen darauf hin, dass die Blockade von CBLB wesentlich zu einer gezielteren Behandlung von aggressiven Lungentumoren beitragen könnte. Langfristig planen wir klinische Studien, die untersuchen sollen, ob unser maßgeschneidertes Konzept dieser neuartigen CAR-T-Zell Therapie das immunsuppressive Tumormikromilieu überwinden und die Erfolgsrate der Behandlung bei LungenkrebspatientInnen im Spätstadium verbessern kann. Sollte sich unser Konzept in präklinischen Modellen bestätigen, ließe sich diese Technologie auf andere, schwer behandelbare Tumore expandieren. Dies wäre ein Durchbruch für zelltherapeutische Behandlungen von Patienten mit soliden Tumoren.“
(Innsbruck, 3. Juli 2023, Text: D. Heidegger, Bilder: MUI/Institut für Zellgenetik)
*) CBLB
Casitas B cell-lymphom-b (CBLB), eine E3-Ubiquitin-Ligase, ist ein wichtiger intrazellulärer Immun-Checkpoint, der die Aktivität von Immunzellen sowohl kontrolliert als auch begrenzt. CBLB ist damit ein integraler Bestandteil wichtiger natürlicher Mechanismen zur Steuerung des Immunsystems. In Tiermodellen kann eine starke durch T- und NK-Zellen verursachte Antitumor-Immunität nachgewiesen werden. Die Blockade von CBLB aktiviert nicht nur gezielt Immunzellen, sondern bietet auch die Möglichkeit, andere relevante Kontrollpunkte wie CTLA-4 und PD-L1/PD-auszuschalten und kann somit als "Master-Checkpoint" in der Krebsimmuntherapie angesehen werden. CBLB kann auf dieser Grundlage als Basis für vielversprechende Ansätze in der Krebsimmuntherapie dienen.
*) Das „Brückenschlagprogramm” BRIDGE der Österreichischen Forschungsförderungsgesellschaft (FFG) wurde im Jahr 2004 als gemeinsame Initiative von FFG und FWF zur Förderung von Projekten an der Schnittstelle zwischen wissenschaftlicher Grundlagenforschung an Instituten und experimenteller Entwicklung in den Unternehmen etabliert.
Über invIOs
invIOs ist ein privates Biotech-Unternehmen mit Sitz in Wien, das sich auf die Entdeckung und Entwicklung neuartiger innovativer Krebsimmuntherapien konzentriert. Mit der firmeneigenen Zelltherapie-Plattform EPiC, bei der intrazelluläre IO-Targets temporär ausgeschaltet werden (Silencing), können Patienten zügig und ambulant mit ihren körpereigenen Zellen, die nur für kurze Zeit außerhalb des Körpers modifiziert werden müssen, behandelt werden. Das wegweisende Behandlungskonzept ermöglicht den Zugang und die Behandlung von Indikationen, die nicht durch die bisherigen Zelltherapie-Ansätze behandelt werden können. www.invios.com