Heiße Doppelspitze gegen kalte Tumoren
Nukleäre Rezeptoren (NR) sind für ihre Rolle bei der Regulation von Tumor- und Immunzellen bekannt. Mit maßgeblicher Beteiligung des Teams um Zellgenetiker Gottfried Baier beschreibt eine neue Forschungsarbeit aus Kalifornien nun erstmals die Rolle des Kernrezeptors NR2F6 bei der tumorinternen Steuerung der Immunabwehr von Melanomzellen – eine Funktion, die für ein verbessertes Ansprechen auf Krebsimmuntherapien beim Melanom von großer Bedeutung ist.
Das verbesserte Ansprechen auf Krebsimmuntherapien ist das Ziel der immunonkologischen Forschung weltweit. Es gilt, vor allem „kalte“, also immunresistente Tumoren wie das Melanom für Immunzellen zugänglich zu machen.
Gottfried Baier – österreichischer Pionier der Krebsimmuntherapieforschung – und seine Arbeitsgruppe setzen dabei auf Immun-Checkpoints im Inneren von Zellen. Mit dem Checkpoint-Molekül NR2F6, das in T-Zellen exprimiert wird, konnten sie einen vielversprechenden Angriffspunkt zur Aktivierung von Immunzellen in unmittelbarer Tumornähe identifizieren und die therapeutische Hemmung von NR2F6 bereits auch präklinisch validieren.
„Seit der ersten Charakterisierung des NR2F6-Signalweges sind wir allerdings nur eine von wenigen Gruppen weltweit, die sich auf NR2F6 fokussieren. So wurden im Zeitraum von 1992 bis 2023 insgesamt nur 82 Publikationen zu NR2F6 publiziert, allein fünfzehn davon kommen aus unserem Labor“, berichtet Gottfried Baier. Eine spezifische Rolle von tumoreigenem NR2F6 im biologischen Kontext der Tumorentstehung in vivo wurde daher bisher nicht untersucht.
Doppelter Antitumoreffekt durch Hemmung von NR2F6
Nun steht NR2F6 im Zentrum einer soeben im Fachjournal Science Advances veröffentlichten Forschungsarbeit unter der Federführung von Ze’ev Ronai vom Sanford Burnham Prebys Medical Discovery Institute in La Jolla, Kalifornien. Am damals unmittelbar benachbarten La Jolla Institute of Allergy and Immunology verbrachte Gottfried Baier von 1990-1994 seine Postdoc-Zeit und konnte jene Kontakte knüpfen, die nun zur erfolgreichen österreichisch-amerikanischen Kooperation führten.
In der neuen Arbeit wurde von den ForscherInnen in La Jolla im Besonderen die Tumorseite beleuchtet und NR2F6 in humanen Melanom-Tumorzellen systematisch aus über 40 NR-Kandidaten anhand pathologischer Expressionsmuster in Melanom-PatientInnenbiopsien als wichtiger negativer Regulator der Anti-Tumor-Immunität identifiziert. „Die neuen Ergebnisse deuten darauf hin, dass die tumorfördernde Aktivität von NR2F6 im soliden Tumormilieu entscheidend durch seine Funktion sowohl in Immunzellen, insbesondere in CD8 T-Zellen, als auch in Tumorzellen reguliert wird. Entscheidend ist, dass diese tumoreigene NR2F6-Aktivität zusätzlich von der Verfügbarkeit tumorexterner Faktoren abhängt, insbesondere auch von Immunzell-eigenem NR2F6 als etabliertem Schlüsselregulator der Anti-Tumor-Immunität“, betont Victoria Klepsch, die die Rolle von NR2F6 als Immun-Checkpoint in Effektor-T-Zellen in der Arbeitsgruppe um Gottfried Baier gemeinsam mit weiteren KollegInnen bereits in vorangegangenen Arbeiten eindrücklich belegen konnte. Nachdem die Forschungsteams zeigen konnten, dass die tumoreigene NR2F6-Funktion ebenfalls von hoher Relevanz für die Aktivierung und Rekrutierung eines geeigneten Tumor-Immun-Mikromilieu-Netzwerks ist, würde die Kombination aus tumoreigener und immunzellulärer NR2F6-Genhemmung geeignet sein, auf synergistische Weise das Tumorwachstum zu blockieren.
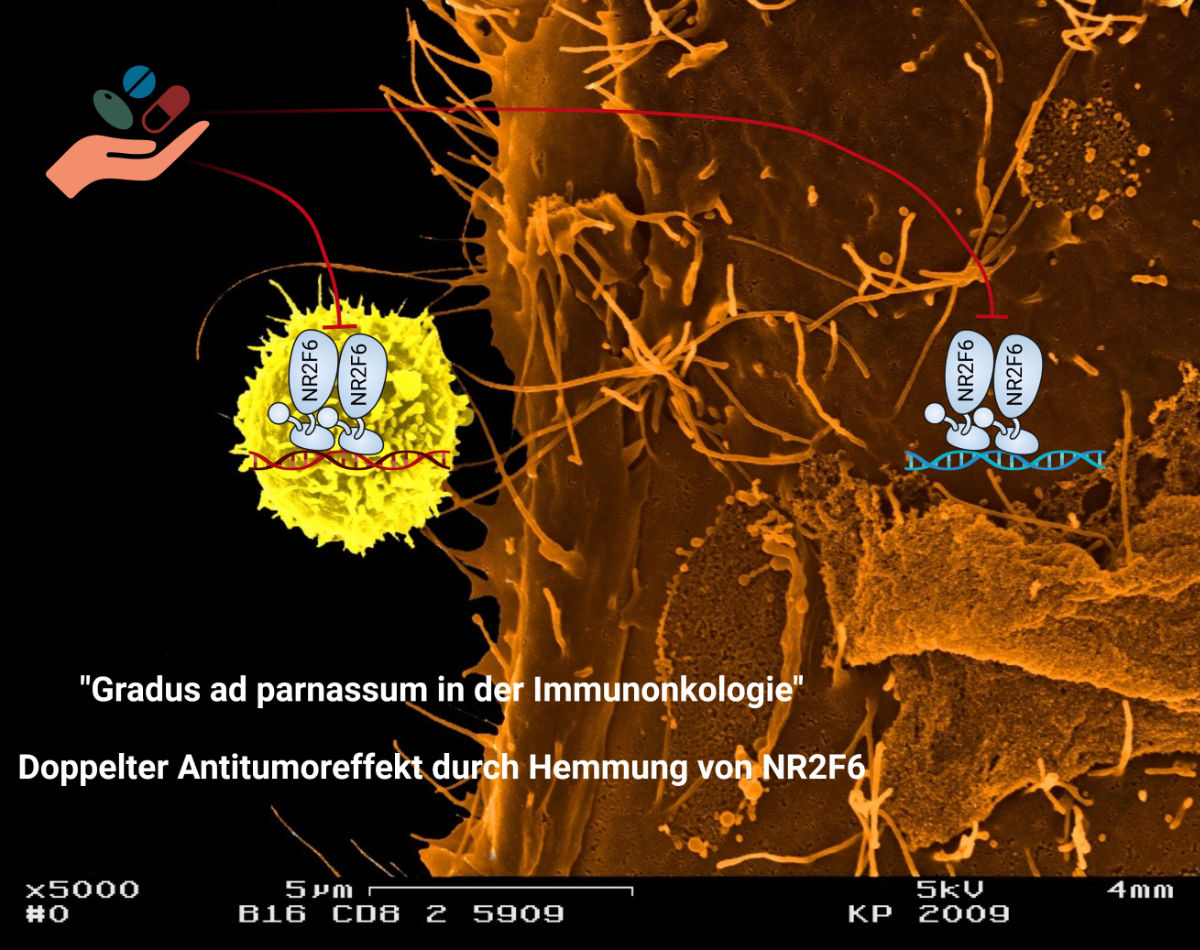
Krebs ist eine fortschreitende Erkrankung, die sowohl vom Tumor als auch vom Immunsystem beeinflusst wird. Die Abbildung veranschaulicht die neue Erkenntnis, nämlich eine duale und tumorfördernde Rolle von NR2F6 in Immun- und Tumorzellen © K.Pfaller/G.Baier
Eine solche Strategie für NR2F6 war vom Innsbrucker Team bereits vor geraumer Zeit vorgeschlagen worden. Die neuen bahnbrechenden Entdeckungen dürften der Entwicklung systemisch verabreichbarer NR2F6-Inhibitoren also erneut Antrieb verleihen. „Ein systemischer NR2F6-Antagonist als pharmakologischer Krebswirkstoff würde, sobald er klinisch verfügbar wäre, sowohl in Melanom-Tumorzellen als auch insbesondere in CD8-T-Zellen einen therapeutischen Nutzen zeigen und damit einen synergistischen Therapieeffekt erzielen. Dank dieser ‚eingebauten Kombinationstherapie-Option‘ könnte ein selektiver NR2F6-Inhibitor tatsächlich den ‚Gradus ad parnassum der klinischen Krebsimmuntherapie‘ darstellen – mit dem einzigartigen Potenzial, die Therapieansprechraten bei den am schwierigsten zu behandelnden Patienten mit metastasiertem Melanom signifikant zu erhöhen“, ist Baier überzeugt.
(06.07.2023, Text: D. Heidegger, Bild: K. Pfaller)
Forschungsarbeit:
Hyungsoo Kim et al, Melanoma-intrinsic NR2F6 activity regulates antitumor immunity.Sci. Adv.9,eadf6621(2023).DOI:10.1126/sciadv.adf6621
Weitere Links:
Intrazellulärer Immunkontrollpunkt NR2F6: neuer Lichtblick in der Krebstherapie
Immun-Checkpoint NR2F6 präklinisch validiert
Doppelerfolg: Zwei neue Christian Doppler Labors für die Medizinische Universität Innsbruck