Überzahl an Zentrosomen löst Entzündung aus
Das PIDDosom und seine Rolle im frühen Krebsgeschehen stehen im Rahmen der mit einem ERC Grant geförderten Forschungsarbeit von Andreas Villunger seit vielen Jahren im Fokus. Neue Erkenntnisse aus seinem Team enthüllen nun für den Proteinkomplex weitere Funktionen mit dualer Wirkung auf Zellzykluskontrolle und Immunität.
Fehler im letzten Schritt der Zellteilung (Zytokinese) können zur Entstehung von Zellen mit vielfachem Chromosomensatz beitragen – ein polyploider Zustand, der zu erhöhtem DNA-Gehalt und zur Bildung zusätzlicher Zentrosomen führt und auch Merkmal vieler Tumorzellen ist. Zentrosomen sind strukturgebende Zellbestandteile, die für die gleichmäßige Verteilung von Chromosomen verantwortlich sind und während der Zellteilung ebenfalls voneinander getrennt werden. Bei unvollständiger Teilung verbleiben zwei Zentrosomen in der nun polyploiden Zelle, die sich vor der nächsten Teilung wieder verdoppeln und damit oft eine ungleichförmige Verteilung von Chromosomen bedingen. „Überzählige Zentrosomen in Tumoren korrelieren mit höherer Aggressivität und schlechter Prognose. Wir wissen aber auch von einer initial schützenden Wirkung, indem der Multiproteinkomplex PIDDosom einen vom Tumorsupressor p53 induzierten Zellzyklusstillstand einleiten kann“, berichtet Entwicklungsimmunologe Andreas Villunger von einer weitreichenden und therapierelevanten Erkenntnis aus seinem Labor.
Zusätzlicher Kontrollmechanismus
In einer neuen, soeben im EMBO Journal unter der Erstautorenschaft von Irmina Garcia-Carpio veröffentlichten Forschungsarbeit beschreibt das Team um Villunger eine zweite, durch das PIDDosom induzierte Antwort auf überzählige Zentrosomen: die Aktivierung von Entzündungsmediatoren. „Wir konnten in Zellkultur nachweisen, dass der Zustand steriler Entzündung ohne Pathogen induziert wird und dazu beiträgt, diese defekten Zellen für andere Immunzellen sichtbarer zu machen. Bindeglied ist das PIDDosom, das hier in anderen Zusammensetzung arbeitet und so die Produktion von Entzündungsfaktoren begünstigt“, erklärt Andreas Villunger den erstmals aufgedeckten Kontrollmechanismus. Die sterile Entzündung erhöht dabei die Aktivität sogenannter NK-Zellen (Natürliche Killerzellen), die als Teil des angeborenen Immunsystems in der Lage sind, Tumorzellen oder virusinfizierte Zellen zu erkennen und abzutöten. Die Eliminierung der Zellen mit überzähligen Zentrosomen könnte sich letztlich als Schutz vor Transformation erweisen. Das PIDDosom zeigt sich damit als Komplex mit zumindest dualer Wirkung, das nicht nur das p53-Netzwerk für die Zellzykluskontrolle, sondern auch die NF-κB-Signalübertragung zur Aktivierung der angeborenen Immunität einbezieht.
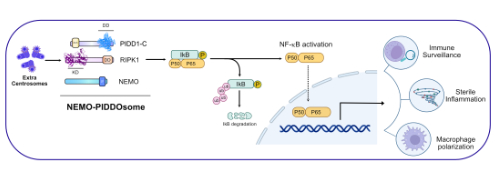
„Auch wenn wir von therapeutischen Optionen noch weit entfernt sind, lässt sich andeuten, dass die Aktivierung des PIDDosoms die Effizienz bestimmter Therapeutika, die mit dem Zellzyklus sowie Zytokinese interferieren und gegenwärtig in Entwicklung sind, steigern könnte“, schließt Entwicklungsimmunologe Villunger.
(21.08.2023, Text: D. Heidegger, Foto und Grafik: Villunger Lab)
Links:
Extra centrosomes induce PIDD1-mediated inflammation and immunosurveillance. Irmina Garcia-Carpio et al., EMBO J., 2023 Aug 2, Online ahead of print
https://doi.org/10.15252/embj.2023113510
Institut für Entwicklungsimmunologie




