Melanom-Therapie: Neue Technologien gewähren komplexe Einblicke ins Tumorgewebe
Bei der Analyse der Resistenzentwicklung im Rahmen der gezielten Therapie mit BRAF-Inhibitoren stehen die dendritischen Zellen oft im Abseits. Tumorimmunologin Patrizia Stoitzner hat diese Immunzellen schon lange im Visier. In der jüngsten Forschungsarbeit nutzten sie und ihr Team neue Multiplex-Technologien, um den komplexen Umbau der Tumormikroumgebung mit Blick auf dendritischen Zellen während der tumorspezifischen Therapie zu beleuchten.
BRAF-Inhibitoren werden zur Behandlung von Krebserkrankungen mit BRAF-Mutation wie bspw. dem Melanom eingesetzt und haben die Überlebensraten der PatientInnen entscheidend verbessert. Die Kombination mit MEK-Inhibitoren (Immuncheckpoint-Inhibitor) trägt außerdem dazu bei, Resistenzentwicklungen, die die Überlebensvorteile langfristig einschränken, hinauszuzögern.
„Wir haben den Effekt des BRAF-Inhibitors untersucht, der sich gezielt gegen die Tumorzelle richtet, um die therapiebedingten immunologischen Veränderungen in der Tumormikroumgebung (TME) zu analysieren. Zahlreiche Arbeiten fokussierten sich in diesem Zusammenhang auf T- und NK-Zellen (Natürliche Killerzellen), dendritische Zellen wurden jedoch außer Acht gelassen“, betont Patrizia Stoitzner, die an der Univ.-Klinik für Dermatologie, Venerologie und Allergologie (Direktor: Matthias Schmuth) das Labor für Langerhans Zellforschung leitet und daran forscht, mit welchen Mechanismen es Tumore schaffen, auf Ebene der dendritischen Zellen die Immunantwort zu unterdrücken.
Gezielte Therapie verändert Tumormikroumgebung
Um die Interaktion von Immunzellen mit Tumorzellen noch detaillierter und direkt im Gewebe zu analysieren und damit neue Einblicke in die komplexe Umgestaltung der Tumormikroumgebung während der zielgerichteten Therapie zu erhalten, entwickelte das Team um Stoitzner mit Erstautor Florian Hornsteiner ein großes Durchflußzytometrie Panel mit 25 Antikörpern. „Wir wollten vor allem die Subtypen der dendritischen Zellen genauer untersuchen und identifizieren“, beschreibt Hornsteiner eine der Forschungsfragen aus seiner Doktorarbeit, die kürzlich im Journal for ImmunoTherapy of Cancer veröffentlicht wurde. Die Forschenden stellten fest, dass die BRAF-Inhibitor-Therapie die Immunogenität des Tumors erhöht, was sich in einer Hochregulierung von Genen widerspiegelte, die mit der Immunaktivierung verbunden sind. Tumor und Tumormikroumgebung wurden entzündlicher, was zu einer Infiltration von aktivierten dendritischen Zellen zusammen mit Effektor T-Zellen führte. Bei der Resistenzentwicklung kehren Tumoren jedoch in einen immunologisch inerten Zustand zurück, da die Ansammlung dendritischer Zellen, entzündlicher Monozyten und T-Zellen vermindert ist.
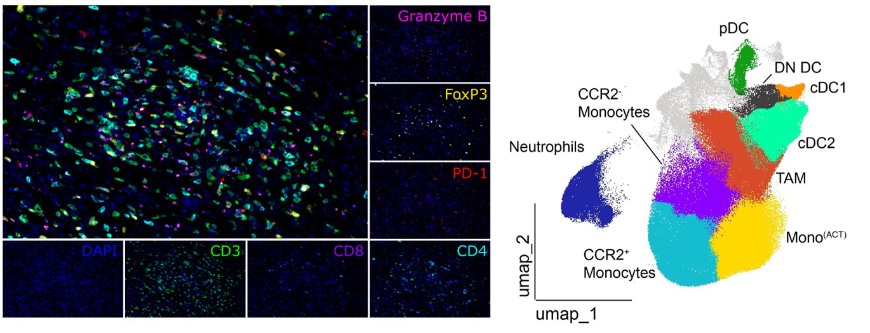
„Ein entzündlicher Tumor reagiert bei immunologischem Reiz. Kombiniert man den BRAF-Inhibitor mit einer Aktivierung von dendritischen Zellen, könnte das einen positiven Effekt auf den Therapieerfolg haben. Das transiente immunogene Tumormilieu enthält mehr dendritische Zellen, die eine immunologische Antwort gegen den Tumor auslösen können – dieses Wissen ist ein entscheidender Faktor für das Timing der Kombinationstherapie“, ergänzt Stoitzner.
Innovative Methoden
Mit Hilfe von Multiplex Immunfluorezenzmikroskopie Analysen (Vectra 3.0 Imaging System), die mit Kooperationspartnern in Dresden durchgeführt wurden, konnte die Infiltration von T-Zellen auch räumlich dargestellt werden, eine gleichzeitige Visualisierung der dendritischen Zellen war jedoch mit dieser Technologie nicht möglich. Das Team um Patrizia Stoitzner möchte daher in Zukunft die zellulären Interaktionen im Tumor noch detaillierter untersuchen. Mit einer neuen Multiplex Mikroskopie Technologie namens MACSima wird das möglich sein. „Diese neue, an der Flow Cytometry Core Unit unter der Leitung von Sieghart Sopper angesiedelte Mikroskopie-Plattform, ermöglicht es, darzustellen, wann welche Immunzellen im Tumorgewebe aktiviert sind und welche komplexen Wechselwirkungen zwischen den Zellen stattfinden“, beschreibt Stoitzner die Vorzüge der innovativen Technologie, mit der anhand von Tumorschnitten über hundert Protein-Marker verwendet und detaillierte Daten über das Expressionsniveau auf Zellen und deren räumlicher Anordnung im Gewebe gewonnen werden können.
Darüber hinaus will das Team um Stoitzner auch die neueste Technologie für die räumliche Analyse von Transkripten (10x Xenium, Core Facility Multiomics, Leiterin: Anne Krogsdam) für weitere Analysen nutzen. Die Kombination aus räumlichen Einzelzellanalysen von 5.000 RNAs (Xenium) und 100 Proteinen (MACSima) wird noch tiefere Einblicke in die komplexen Zell-Zell-Interaktionen im Tumorgewebe zulassen.
(23.05.2024, Text: D. Heidegger, Bilder: Stoitzner)
Links:
Tumor-targeted therapy with BRAF-inhibitor recruits activated dendritic cells to promote tumor immunity in melanoma.
https://doi.org/10.1136/jitc-2023-008606
Labor für Langerhans Zellforschung