Molekulare „Anstandsdamen“ entschlüsseln seltene Erkrankung
Einem internationalen Forscherteam der Medizinischen Universität Innsbruck ist ein wichtiger Durchbruch in der Erforschung des seltenen O2HE-Syndroms (Osteo-oto-hepato-enteric syndrome) gelungen. Die neuen Erkenntnisse wurden kürzlich als Titelstory im renommierten „Journal of Clinical Investigation Insight“ veröffentlicht - ein weiterer herausragender Erfolg für die Erforschung seltener Krankheiten in Tirol.
Das O2HE-Syndrom ist eine extrem seltene Erbkrankheit, die den Betroffenen eine verheerende Kombination von Symptomen beschert: Knochen, die schon bei geringster Belastung brechen, fortschreitender Hörverlust, schwere Leberschäden und lebensbedrohliche Durchfälle. "Für die Patienten und ihre Familien ist diese Diagnose und das Management dieser Erkrankung eine immens hohe Belastung. ", erklärt Andreas Janecke von der Universitätsklinik für Kinder- und Jugendheilkunde I. Er hat das verantwortliche Gen mit der vorliegenden Mutation in diesen Patienten identifiziert.
Die molekulare Anstandsdame
Im Zentrum der Entdeckung steht das Protein UNC45A, das von den ForscherInnen liebevoll "molekulare Anstandsdame" genannt wird: „Ähnlich einer Anstandsdame aus dem 19. Jahrhundert, den sogenannten Chaperonen, sorgt dieses Protein dafür, dass sich andere Proteine ungestört und richtig entwickeln können, um ihre wichtigen Aufgaben in der Zelle zu erfüllen“ erklärt Stephanie Waich (Institut für Zellbiologie, Biozentrum), die mit ihrer Doktorarbeit wesentlich zu den Ergebnissen beigetragen hat.
Doch bei O2HE-Patienten gerät diese Anstandsdame aus dem Takt: "Die von uns untersuchte Mutation führt dazu, dass das Protein seine Schutzbefohlenen geradezu erdrückt - wie eine überfürsorgliche Gefährtin, die ihren Schützling nicht mehr aus den Augen lässt", beschreibt Waich das Phänomen.

BU v.l.: Taras Valovka, Stefanie Waich, Lukas A. Huber, Thomas Müller, Andreas Janecke und Julia Vodopiutz von der Med Uni Wien. Michael Hess fehlt auf dem Bild krankheitsbedingt. (Bild: MUI/D. Bullock)
Forschungsergebnisse im Detail
Im Zentrum der Untersuchungen stand eine besondere Veränderung im UNC45A-Gen, die bei Patientinnen und Patienten mit dem seltenen O2HE-Syndrom auftritt. Diese spezifische Mutation, in der Fachsprache als UNC45A c.710T>C (p.Leu237Pro) bezeichnet, zeigt ein ungewöhnliches Verhalten, das sie von anderen bekannten Genveränderungen, die zum Verlust der UNC45A-Funktion führen, unterscheidet.
Das mutierte UNC45A-Protein verhält sich paradox: Einerseits kann es seine eigentliche Aufgabe als molekularer Begleiter – in der Wissenschaft als Chaperon bezeichnet – noch erfüllen. Das bedeutet, es unterstützt weiterhin andere Proteine, insbesondere Motorproteine wie Myosine, dabei, sich korrekt zu falten und ihre Funktionen auszuüben. Andererseits neigt die veränderte Form des Proteins dazu, ungewöhnlich stabile Klumpen, sogenannte Oligomere, zu bilden. Diese Klumpen lösen sich nicht mehr auf, sodass das Protein gewissermaßen stecken bleibt und seinen natürlichen Arbeitszyklus nicht mehr durchlaufen kann.
Normalerweise sollte sich UNC45A nach getaner Arbeit von seinen Partnerproteinen trennen, ähnlich wie ein gut eingespieltes Team, das nach Projektabschluss auseinandergeht. Die Mutation verhindert diese Trennung – vergleichbar mit einem Klebstoff, der nicht mehr löslich ist und alles unfreiwillig zusammenbindet.
Diese Fehlfunktion hat schwerwiegende Folgen für die gesamte Zelle. Der Transport wichtiger Stoffe innerhalb der Zelle wird gestört, sodass sie nicht mehr ordnungsgemäß verteilt werden können. Gleichzeitig ist das Recycling-System der Zelle beeinträchtigt: Bestimmte Moleküle können nicht mehr wiederverwertet werden, was zu schädlichen Ablagerungen führt. Besonders auffällig ist der Stau an zellulären Verkehrsknotenpunkten – z.B. das Eisentransport-Protein Transferrin, das normalerweise für den Eisentransport zuständig ist, wird an falschen Stellen festgehalten und kann seine Aufgabe nicht mehr erfüllen.
Doch die Forscherinnen und Forscher entdeckten auch einen vielversprechenden Ansatz: Die normale, gesunde Version des UNC45A-Proteins – in der Fachsprache als Wildtyp bezeichnet – kann die schädlichen Effekte der Mutation abschwächen. Wenn beide Formen, die mutierte und die gesunde, gemeinsam in der Zelle vorkommen, bilden sich weniger der problematischen Protein-Klumpen. Diese Beobachtung könnte wegweisend für die Entwicklung neuer Therapieansätze sein. Eine mögliche Strategie wäre, gezielt in den Prozess der Proteinaggregation einzugreifen und die Bildung der schädlichen Klumpen zu unterdrücken.
Internationale Detektivarbeit
Die Aufklärung dieses Mechanismus war nur durch eine einzigartige internationale Zusammenarbeit möglich. "Bei so seltenen Erkrankungen können wir auf unser internationales Netzwerk und unsere langjährigen Kooperationspartner aus der ganzen Welt zurückgreifen, ohne deren Bereitschaft, klinische Daten von Patient:innen zu teilen, diese Forschung nicht möglich wäre“, betont Thomas Müller (Direktor Universitätsklinik für Kinder- und Jugendheilkunde I). Teams aus Wien, Paris, Oxford und der Türkei haben entscheidende klinische Daten beigesteuert.
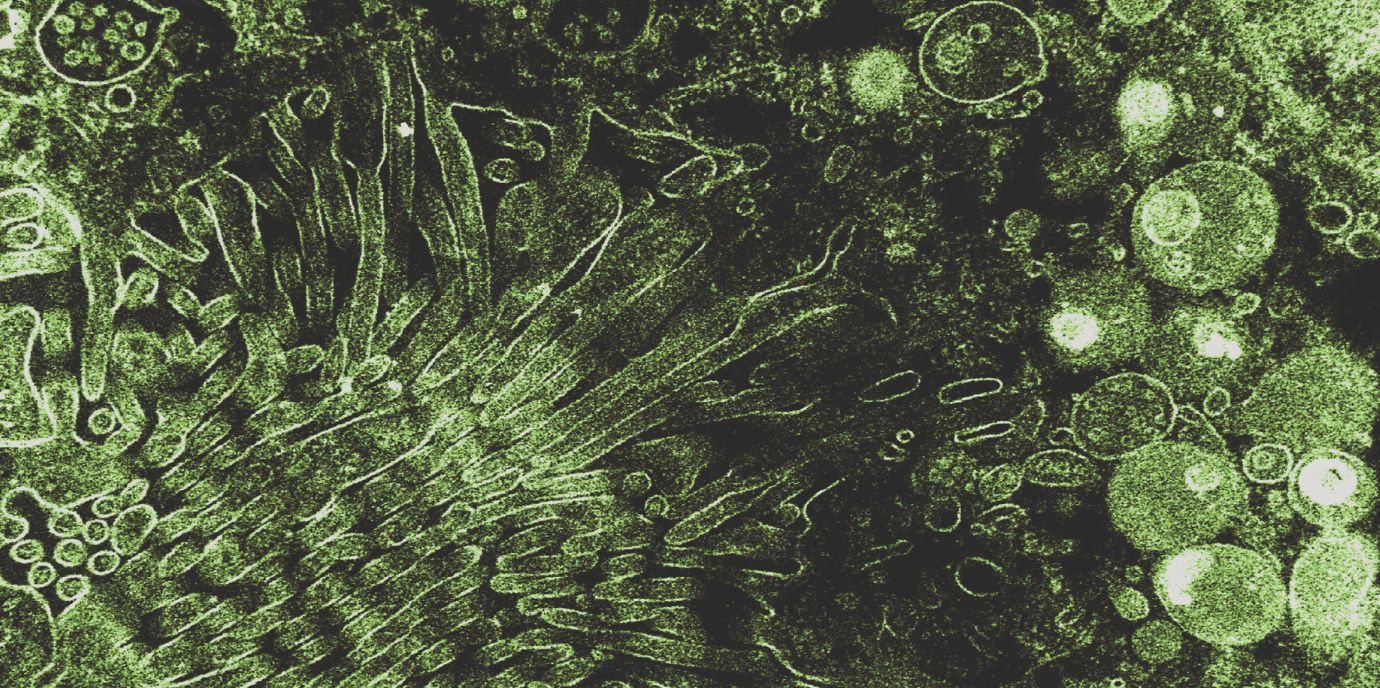
BU: Das Titelbild zeigt eine faszinierende elektronenmikroskopische Aufnahme eines mittels genetischer Veränderungen maßgeschneiderten Darmzellmodells. Die Zellen wurden in Sekundenbruchteilen schockgefroren, um die dynamische Zellultrastruktur wirklichkeitsgetreu zu erhalten. Man erkennt einem Gorgonenhaupt ähnliche, abnormal geformte und völlig deplazierte Mikrovillus-Zellfortsätze, begleitet von ungewöhnlichen Anhäufungen wichtiger, für Abbauprozesse verantwortlichen Zellorganellen. Das Besondere dieses Modells ist, dass es in höchstem Maß die Merkmale von Zellen nachahmt, die bei PatientInnen mit der seltenen genetischen Erkrankung Osteo-Oto-Hepato-Enteric Syndrome vorkommen.
Elektronenmikroskopische Aufnahmen von Michael Hess (Institut für Histologie und Embryologie) lieferten fast erschreckende Einblicke in die zellulären Veränderungen. "Unsere Bilder führen uns drastisch vor Augen, wie die Zelle unter dieser Überfürsorge leidet", so Hess, dessen Aufnahmen auch die Grundlage für das künstlerische Cover der Fachzeitschrift bildeten.
Ein Modell für die Zukunft
"Die Bedeutung dieser Arbeit geht weit über das reine Verständnis hinaus", erklärt Lukas A. Huber, Leiter des Instituts für Zellbiologie am Biozentrum. Die Studie stehe beispielhaft für den Erfolg moderner medizinischer Forschung: "Von der ersten Beobachtung am Patienten über die grundlegende zellbiologische Aufklärung bis hin zu möglichen Therapieansätzen - dieser translationale Ansatz zwischen Kliniken und medizinisch-theoretischen Instituten ist die Zukunft der Medizin und ein Alleinstellungsmerkmal der Medizin Uni Innsbruck", so Huber.
Hoffnung für Betroffene
Für PatientInnen mit seltenen Krankheiten wie dem O2HE-Syndrom sind solche Erkenntnisse von unschätzbarem Wert. "Jedes bisschen mehr Verständnis gibt uns neue Werkzeuge im Kampf gegen diese schweren Krankheiten in die Hand", fasst Waichs Doktorvater Taras Valovka zusammen. "Und es zeigt, dass auch die seltensten Krankheiten in unserer vernetzten Forschungslandschaft nicht vergessen werden."
(23.4.2025, Text: L. Huber, Bilder: M. Hess/D. Bullock)
Links:
JCI Insight, March 24
Altered chaperone–nonmuscle myosin II interactions drive pathogenicity of the UNC45A c.710T>C variant in osteo-oto-hepato-enteric syndrome. Stephanie Waich et al.