Fehlendes NR2F6 macht widerstandsfähiger gegen Salmonellen
Der Immunrezeptor NR2F6 beeinflusst die Phagozytose in Makrophagen. Dies hat wiederum Auswirkungen auf Salmonellen-Infektionen. Ein Projekt, das Natascha Kleiter vom Institut für Zellgenetik in Kooperation mit Forscher:innen der Universitätsklinik für Innere Medizin II durchgeführt hat, zeigt, dass Nr2f6-defiziente Mäuse vor Salmonellen-Infektionen geschützt sind.
Mäuse, denen der Nuklearrezeptor NR2F6 fehlt (Nr2f6-/-), überstehen eine Salmonellen-Infektion deutlich besser als Wildtyp-Tiere. Sie verlieren kein Gewicht, weisen geringere Bakterienlasten in Milz und Leber auf und zeigen niedrigere Spiegel entzündungsfördernder Zytokine im Blut. Das ist die zentrale Erkenntnis einer Forschungsarbeit um Natascha Kleiter vom Institut für Zellgenetik (Direktor: Gottfried Bayer) an der Medizinischen Universität Innsbruck. Kleiters Team führte das Projekt gemeinsam mit Kolleg:innen um Günter Weiss von der Universitätsklinik für Innere Medizin II durch. Die Studie mit dem Titel “Loss of NR2F6 Protects from Salmonella Typhimurium Infection“, wurde im Fachjournal Advanced Science veröffentlicht.
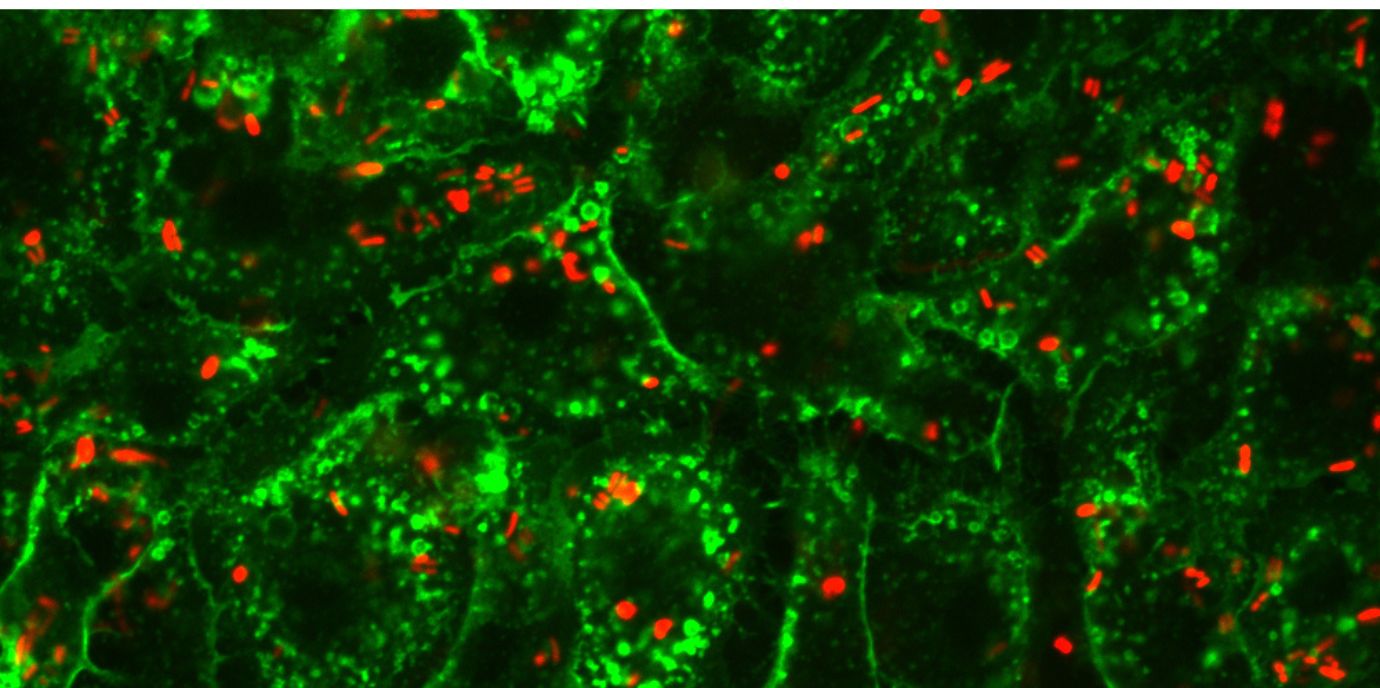
„Eine wichtige Erkenntnis der letzten Jahre ist, dass Makrophagen* je nach Gewebe sehr unterschiedlich spezialisiert sind. Viele davon entstehen schon in der Embryonalentwicklung und bleiben lebenslang im jeweiligen Gewebe“, schildert Kleiter vorangegangene Erkenntnisse. Das Team untersuchte deshalb mittels Durchflusszytometrie* zunächst die Makrophagen verschiedener Organe in gesunden Wildtyp- und Knockout-Mäusen. Dabei stellte sich heraus, dass in Nr2f6-/--Tieren bestimmte Makrophagenpopulationen in Milz, Leber und Lunge reduziert waren. Zusätzlich analysierte das Team im Labor aus Knochenmark gewonnene Makrophagen, um Umgebungseinflüsse auszuschließen.
In den anschließenden Infektionsversuchen produzierten die Nr2f6-/--Mäuse weniger entzündungsfördernde Zytokine, wiesen eine geringere Bakterienlast auf und zeigten insgesamt eine abgeschwächte Aktivierung des Immunsystems. Salmonellen nutzen normalerweise Makrophagen als Rückzugsort aus und werden von ihnen im Körper weitertransportiert. Dabei profitieren sie vom dort gespeicherten Eisen, das sie für ihr Wachstum benötigen. Der Körper versucht im Infekt zwar, verfügbares extrazelluläres Eisen zu reduzieren, doch dadurch steigt gerade in Makrophagen die Eisenkonzentration. Das Team fand Hinweise darauf, dass NR2F6 diesen Eisenstoffwechsel während der Salmonelleninfektion mittels Makrophagen reguliert.
Eine tiefergehende Analyse der Genexpression zeigte eine verstärkte Expression des Signalregulationsprotein Sirpα. Dieser Rezeptor bindet an CD47 an der Oberfläche körpereigener Zellen und verhindert deren Aufnahme in Makrophagen. Wird Sirpα blockiert, verändert sich auch die Fähigkeit der Makrophagen, Erreger aufzunehmen. In vitro konnte das Team die Phagozytose der Nr2f6-/--Makrophagen durch Sirpα-Blockade wieder auf Wildtyp-Niveau anheben.
In den in vivo-Experimenten fanden die Forschenden schließlich deutlich weniger Eisen in Milz und Leber der Knockout-Tiere – vermutlich ein Grund dafür, dass sich Salmonellen dort schlechter vermehren konnten. Auch im Blut waren deutlich geringere Bakterienmengen nachweisbar.
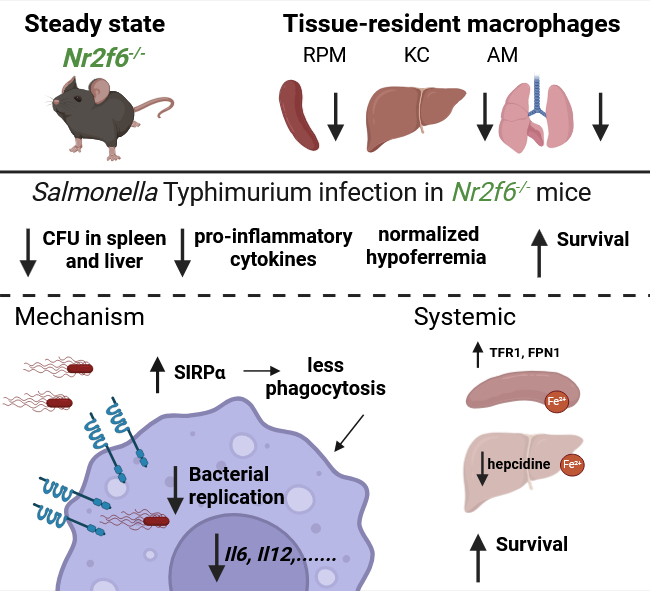
Die Arbeit zeigt somit, dass NR2F6 nicht nur ein Regulator von Entzündungsprozessen ist, sondern auch eine bisher nicht erkannte Funktion in der Wirts-Pathogen-Interaktion innehat – insbesondere in Bezug auf gewebeansässige Makrophagen, Phagozytose und Eisen-Metabolismus. NR2F6 stellt damit ein potenzielles therapeutisches Ziel für Infektionskrankheiten dar.
(Innsbruck, am 13. November 2025, Text: red, Bild: Martin Hermann, Grafik: Adv. Sci/Institut für Zellgenetik)
Forschungsarbeit:
Woelk, C. Pfeifhofer-Obermair, J. Benz, et al. “Loss of NR2F6 Protects from SalmonellaTyphimurium Infection.” Adv. Sci.12, no. 37 (2025): 12, e04280.
https://doi.org/10.1002/advs.202404280
*Makrophagen: spezialisierte Immunzellen; Fresszellen, die Erreger und Zellreste aufnehmen und abbauen
**Durchflusszytometrie: Ein Verfahren, mit dem Zelltypen anhand ihrer Oberflächenmerkmale gezählt und unterschieden werden können.